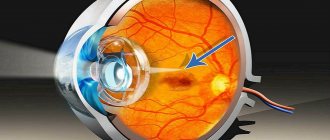
При врожденной гипертрофии пигментного эпителия сетчатки речь идет о нарушении формирования этого слоя в период внутриутробной жизни. Проявляется заболевание сгруппированной пигментацией, которая имеет внешнее сходство со следом медведя.
До конца патогенез гипертрофии сетчатки не изучен. Некоторые ученые полагают, что в результате формирования в патологической сетчатке макромеланосом происходит изменение катаболической функции. В результате клетки пигментного эпителия погибают, а на их месте формируются лакуны, или очаги гипогигментации.
Строение
Пигментный эпителий сетчатки образован одним слоем гексагональных эпителиальных клеток, имеющих большое количество меланосом, содержащих пигмент меланин[2]. Базальной мембраной для пигментного эпителия служит самый внутренний слой мембраны Бруха. В центре, вблизи жёлтого пятна, эпителиоциты выше, на периферии сетчатки становятся несколько шире и ниже. Ядра у пигментоцитов размещены ближе к базальному «светлому» полюсу, на апикальном полюсе присутствует большое количество микроворсинок (ресничек) и меланосом, которые словно укутывают внешний сегмент фоторецепторных клеток. Различают длинные и короткие микроворсинки. Короткие микроворсинки соединяются с концами наружных сегментов фоторецепторов, а длинные — расположены между внешними сегментами.
Мышца-расширитель зрачка происходит из пигментного эпителия сетчатки, и её гладкомышечные клетки пигментированы.
Функции
- Поглощение света. Меланосомы эпителиоцитов обеспечивают поглощение большей части света, который попал в глаз и не поглотился фоторецепторами. Поглощение световых лучей препятствует отражению и рассеянию света по сетчатке, что позволяет сохранить контрастность и чёткость изображения. Под действием света меланосомы эпителиоцитов мигрируют в апикальную поверхность клеток, в микроворсинки, чтобы укутать внешние световоспринимающие сегменты фоторецепторов. В темноте меланосомы в определенной степени возвращаются обратно в центральную часть клетки при участии микрофиламентов и гормона меланотропин. Функцию поглощения света обеспечивают главным образом длинные микроворсинки.
- Фагоцитоз отработанных дисков фоторецепторов. В процессе деятельности фоторецепторов образуется большое количество отработанных мембранных дисков со зрительным пигментом. Они подлежат фагоцитозу короткими микроворсинками пигментоцитов. Эти клетки также обеспечивают поставку необходимых веществ для восстановления мембраны фоторецепторов. Каждый пигментоцит ежесуточно фагоцитирует 2-4 тысячи отработанных дисков.
- Запасание витамина А, предшественника ретиналя. При поглощении фотона 11-цис-ретиналь изомеризируется в транс-ретиналь, и проходит формирование электрического импульса. Восстановление 11-цис-ретиналя проходит значительной мере с участием пигментоцитов.
- Обеспечивает выборочную поставку необходимых питательных веществ фоторецепторам от сосудистой оболочки и отвод продуктов распада в обратном направлении. Эта функция обеспечивается преимущественно короткими микроворсинками, которые сочетаются с концами наружных сегментов фоторецепторов. Пигментный эпителий сетчатки обеспечивает так называемый внешний гемато-ретинальный барьер, который препятствует попаданию в сетчатку из хориокапилляров больших молекул.
- Отвод воды и ионов. Пигментный эпителий обладает способностью активно отводить ионы из межклеточного пространства. Вследствие уменьшения осмотического давления, отводится и вода. Этим достигается адгезия наружных слоев сетчатки и уменьшается возможность её отслоения.
- Отвод лишнего тепла к сосудистой оболочке.
Таким образом, пигментный эпителий, фоторецепторы и хориоидеа представляют собой функциональное единство.
Сетчатка │ Часть 1
Описание
Сетчатая оболочка
(retina) привлекала внимание исследователей на протяжении многих веков. Первым описал ее Chacedon в 330 г. до н. э. Название этой структуре дал Rufos Ephesus (приблизительно 110 г. н. э.), который предполагал, что сетчатка является сетью, поддерживающей стекловидное тело.
На протяжении многих веков ни у одного из исследователей не возникало мысли о связи сетчатки с мозгом. Лишь Кеплер в 1608 г. предположил о том, что сетчатка является «первичной тканью зрительного рецептора».
Первое детальное микроскопическое исследование сетчатки проведено Тревианусом (Тrеvianus) в 1835 г. Последующее совершенствование микроскопической техники, приготовления тонких срезов и методов окрашивания препаратов позволило выявить нейронную организацию сетчатки, а также особенности синаптических контактов между нейронами и роль нейронных связей в обработке зрительной информации.
Изучению сосудистой сети сетчатки способствовало развитие методов исследования плоскостных препаратов сетчатки после обработки ее трипсином, применения методов флюоресцентной ангиографии. Бурное развитие нейроанатомии сетчатой оболочки связывают с развитием методов иммуногистохимии
, позволяющих с большой точностью выявить в определенной структуре сетчатки специфические вещества, в частности нейротрасмиттеры. Сочетание методов морфологии, иммуногистохимии и нейрофизиологии (регистрация мембранных потенциалов отдельной клетки) позволило к настоящему времени получить достаточно полную картину относительно механизмов восприятия и обработки световой энергии сетчатой оболочкой.
Общая анатомия
. Сетчатка является частью внутренней оболочки глаза (tunica internet bulbi) и представляет собой прозрачную ткань, выстилающую внутреннюю поверхность глазного яблока, занимая при этом 3/4 ее площади. Распространяется она от диска зрительного нерва до зубчатой линии (ora serrata), переходя в этой области в пигментный эпителий ресничного тела. Сенсорная (световоспринимающая) часть сетчатки прилежит к пигментному эпителию сетчатки, от которого она легко отделяется. Наиболее сильная связь с подлежащими тканями определяется в области зубчатой линии и у края диска зрительного нерва, вблизи желтого пятна (macula luted).
В области экватора
сетчатка имеет вертикальный диаметр 24,08 ± 0,94 мм и горизонтальный — 24,06 ± 0,60 мм. Расстояние от края диска зрительного нерва до верхней части экватора равняется 14,71 ± 1,08 мм, до нижней части — 14,51 ± 1,01 мм. с носовой стороны— 13,27 ± 1,11 мм, с височной стороны — 17,29 ± 1,6 мм. В указанных границах площадь сетчатой оболочки равняется 1206 мм2. Переднюю часть сетчатки рассматривают от экватора до зубчатой линии. При этом расстояние от экватора до зубчатой линии с височной стороны равно 6,0 ± 1,22 мм, с носовой стороны — 5,8 ± 1,12 мм, сверху — 5,07 ± 1,11 мм, снизу— 4,79 ± 1,22 мм. Расстояние от переднего края сетчатки до линии Швальбе сверху равно 6,14 ± 0.85 мм, снизу — 6,2 ± 0,76 мм, с носовой стороны — 5,73 ± 0,81 мм и с височной — 6,52 ± 0,75 мм.
Микроскопическая анатомия
. Сетчатка является наиболее сложным в структурном и функциональном отношениях образованием глаза и выполняет основную функцию — фоторецепцию. Столь сложное в структурном и функциональном отношениях образование можно рассматривать с разных позиций. По этой причине существует несколько классификаций ее строения — функциональная классификация, гистогенетическая и анатомическая. В соответствии с функциональной классификацией сетчатку подразделяют на нейроны, глию и сосудистую систему.
Гистогенетическая классификация отличается тем, что отдельные структуры сетчатки подразделяют в соответствии с особенностями их происхождения. В этой связи выделяют производные нейроэпителия (нейроны, глия), мезенхимы (сосудистая система).
Анатомическая классификация описывает особенности микроскопического строения сетчатки. Именно на ней мы и остановимся в этом разделе. Морфо-функциональные особенности сетчатой оболочки будут приведены в главе 4.
При световой микроскопии в сетчатке выделяют 11 слоев
(рис. 3.6.1):
Рис. 3.6.1.
Гистологическое строение сетчатой оболочки:
а — (1 — сетчатая оболочка; 2— пигментный эпителий сетчатки; 3—участок сосудистой оболочки); б—послойное строение сетчатой оболочки (большое увеличение) (1—внутренняя пограничная мембрана; 2 — слой ганглиозных клеток; 3 — внутренний плексиформный слой; 4 — внутренний ядерный слой; 5 — наружный плексиформный слой; 6 — наружный ядерный слой; 7 — наружная пограничная мембрана; 8 — внутренние членики фоторецепторов: 9 — наружные членики фоторецепторов; 10 — пигментный эпителий сетчатки)
- Мембрана Бруха.
- Пигментный эпителий сетчатки.
- Слой фоторецепторов, палочек и кол бочек.
- Наружная пограничная мембрана.
- Наружный ядерный слой.
- Наружный плексиформный (сетчатый) слой.
- Внутренний ядерный слой.
- Внутренний плексиформный (сетчатый) слой.
- Слой ганглиозных клеток.
- Слой нервных волокон.
- Внутренняя пограничная мембрана.
Ряд исследователей мембрану Бруха рассматривают одновременно с сосудистой оболочкой. Гистогенетически мембрана Бруха одновременно относится как к сосудистой оболочке, так и сетчатой оболочке.
Пигментный эпителий
При удалении внутренней сенсорной части сетчатки от внутренней поверхности глазного яблока открывается пигментный эпителий
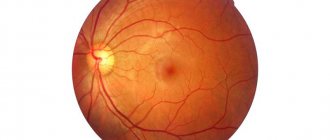
(пигментная часть сетчатки; pars pigmentosa). Выглядит он в виде коричневой непрерывной пластинки, простирающейся от зрительного нерва до зубчатой линии. Затем он переходит на ресничное тело в виде пигментного эпителия. Наиболее пигментирован эпителий в области желтого пятна. Пигментный эпителий сетчатой оболочки выполняет многообразные функции. Первоначально предполагали, что пигментный эпителий является просто черным фоном, снижающим рассеивание света в процессе фоторецепции. В конце XIX в. установили, что отделение сенсорной части сетчатки от пигментного эпителия приводит к потере зрения. Это исследование позволило предположить важную роль пигментного эпителия в фоторецепции. Многочисленные исследования последнего времени установили наличие взаимодействия клеток пигментного эпителия с фоторецепторами. Использование электронной микроскопии выявило наличие фагоцитарной активности эпителиоцитов. Определенную роль в установлении функции пигментных клеток сыграло применение культуры тканей.
Мы перечислим лишь некоторые из функций пигментного эпителия сетчатки. Более подробные сведения приведены в табл. 3.6.1.
Таблица 3.6.1.
Функции пигментного эпителия сетчатой оболочки (по linn, Benjamin-Henkind, 1979)
Пигментный эпителий способствует формированию фоторецепторов в эмбриогенезе
, индуцируя этот процесс, обеспечивает функционирование гемато-ретинального барьера, поддерживает постоянство среды между пигментным эпителием и фоторецепторами, поддерживает структуру контакта между наружными сегментами палочек и колбочек и клетками пигментного эпителия, обеспечивает активный избирательный транспорт метаболитов между сетчаткой и увеальным трактом, осуществляет транспорт, накопление и изомеризацию витамина А. осуществляет фагоцитоз наружных сегментов фоторецепторов, а также поглощение световой энергии гранулами меланина, осуществляет синтез гликозаминогликанов, окружающих наружные сегменты фоторецепторов.
Клетки пигментного эпителия фагоцитируют до 10% наружных члеников фоторецепторов ежедневно. Способность фагоцитировать наружные сегменты палочек и колбочек является прямым доказательством постоянной регенерации последних.
Поглощение световой энергии меланиновыми гранулами обеспечивает четкую топографическую регистрацию световой энергии наружными сегментами фоторецепторных клеток, окутанных отростками клеток пигментного эпителия, содержащими зерна меланина. Это обеспечивает световую изоляцию каждого фоторецептора. При усилении освещенности глазного яблока зерна меланина мигрируют в отростки клеток пигментного эпителия. При этом степень изоляции фоторецепторов усиливается.
Поглощение и транспортировка ретинола
(витамин А) обеспечивается рецепторами, расположенными на базальной и латеральной поверхностях клеток пигментного эпителия. Клетки пигментного эпителия синтезируют особый гликопротеид, который переносит ретинол в интерфоторецепторный матрикс, откуда он и поступаете фоторецепторы.
Необходимо отметить, что нарушение функции пигментного эпителия лежит в основе развития ряда заболеваний. Его структурные изменения выявлены при возрастной макулопатии, центральной серозной ретинопатии, дистрофии сетчатки. Эти изменения хорошо выявляются офтальмоскопически.
Клетки пигментного эпителия чувствительны к ряду токсинов.
Пигментный эпителий сетчатки расположен между хориокапиллярным слоем сосудистой оболочки и сенсорной частью сетчатки
(рис. 3.6.1—3.6.4).
Рис. 3.6.2.
Пигментный эпителий сетчатой оболочки:
а — поперечный срез (1 — наружные членики палочек и колбочек; 2 — клетки пигментного эпителия; 3— базальная пластинка (мембрана Бруха); 4 — собственно сосудистая оболочка); б—плоскостной препарат
Рис. 3.6.3.
Плоскостной препарат пигментного эпителия сетчатой оболочки. Эпителиоциты полигональной формы и интенсивно пигметированы
Рис. 3.6.4.
Сканирующая электронная микроскопия сетчатки (Ст) и связи ее с пигментным эпителием (Пм) (по Kessel, Kardon, 1979):
наружные сегменты (Не) фоторецепторов контактируют с отдельными клетками пигментного эпителия (I, II). Вакуоли (Вк) в клетках пигментного эпителия появляются в результате потери зерен меланина при гистологической обработке тканей. Слева внизу показано большее увеличение участка, приведенного в рамке на верхнем снимке. Справа снизу показана базальная поверхность клеток пигментного эпителия после снятия мембраны Бруха. Между клетками виден юнкциональный комплекс в виде мостиков
Он представляет собой один слой уплощенных интенсивно пигментированных клеток, плотно прилежащих друг к другу и имеющих гексагональную форму (рис. 3.6.2; 3.6.3). Размеры клеток широко варьируют в зависимости от их расположения. В фовеолярной области они выше (высота 14—16 мкм), уже (10—14 мкм), чем в области зубчатой линии (ширина 60 мкм).
Клетки, лежащие по периферии, уплощены и менее пигментированы. Вблизи зубчатой линии встречаются многоядерные клетки, а зерен меланина меньше.
На момент рождения
у человека обнаруживается порядка 4—6 млн клеток. В процессе развития организма плотность клеток пигментного эпителия увеличивается в области желтого пятна, достигая максимума к 6 месяцам. И. наоборот, в области зубчатой линии число клеток быстро уменьшается на протяжении первого года жизни.
С возрастом пигментные клетки в области желтого пятна увеличиваются в высоте и уменьшаются в ширине. Обратная закономерность обнаруживается по периферии сетчатки. Фигуры митотических делений в эпителиальном пласте практически не обнаруживаются.
Строение клеток
. Как и в любых эпителиальных клетках организма человека в клетках пигментного эпителия сетчатой оболочки различают апикальную и базальную части. С базальной стороны к ним прилежит
базальная мембрана
(рис. 3.6.5).
Рис. 3.6.5.
Особенности ультраструктурной организации клеток пигментного эпителия сетчатки и контактов между клетками:
1 — цитоплазматические отростки; 2 — юнкциональный комплекс, расположенный между соседними клетками: 3 — мембрана Бруха: 4 — соединительная ткань
При световой микроскопии ткань, лежащая между пигментным эпителием и хориокапиллярным слоем сосудистой оболочки гомогенного строения, и была названа Брухом стекловидной пластинкой
(lamina vitrea), в последующем она получила название мембрана Бруха (compexus (lamina) basalis (Bruch)). При использовании более точных методов световой микроскопии в мембране Бруха выделены следующие части: наружная кутикулярная часть и более волокнистая — внутренняя часть. Поскольку внутренняя часть мембраны Бруха интенсивно окрашивается при применении методов, выявляющих эластическую ткань, ее назвали «lamina elastica».
Особенности строения мембраны Бруха
и ее толщина зависят как от локализации исследуемого участка, так и от возраста индивидуума. У взрослых толщина мембраны в перипапиллярной области равна 2—4 мкм, а в периферических—1—2 мкм. У детей толщина ее в центральных участках равна 2 мкм.
Ультраструктурные исследования позволили выделить в мембране Бруха пять слоев (зон)
:
- базальная мембрана пигментного эпителия,
- внутренний коллагеновый слой,
- слой волокон (эластический),
- наружный коллагеновый слой,
- базальная мембрана клеток эндотелия хориокапилляров (рис. 3.6.6— 3.6.8).
Рис. 3.6.6.
Объемное схематическое изображение внутреннего слоя сосудистой оболочки и пигментного эпителия сетчатки, между которыми располагается мембрана Бруха (по Hogan ei al., 1971):
1 — цитоплазматические отростки клеток пигментного эпителия; 2 — наружный сегмент палочки; 3 — запирающая лента; 4— десмосома; 5 — ядро клетки пигментного эпителия; 6 — митохондрии; Г — комплекс Гольджи; 5 — пигментные гранулы; 9 — фагосомы; 10—гладкий эндоплазматический ретикулум; 11— базальная мембрана; 12—эластическая зона мембраны Бруха; 13 коллагеновые фибриллы мембраны Бруха; 14 — хориокапилляры сосудистой оболочки (стрелкой указаны поры); 15 — коллагеновые волокна, расположенные между капиллярами сосудистой оболочкиРис. 3.6.7.
Схема структурной организации мембраны Бруха (по Hogan et al., 1971):
1 — базальная мембрана пигментного эпителия сетчатки; 2— передняя коллагеновая зона; 3 — эластический слой; 4 — наружный коллагеновый слой: 5 — базальная мембрана хориокапилляров: б — пигментный эпителий; 7 — эндотелиальная клетка хориокапилляровРис. 3.6.8.
Ультраструктура мембраны Бруха:
1 — базальная мембрана клеток пигментного эпителия; 2 — внутренний коллагеновый слой мембраны Бруха толщиной 2,5 мкм; 3 — эластический слой мембраны Бруха; 4 — наружный коллагеновый слой толщиной 0,7 мкм. 5 — базальная мембрана эндотелиальных клеток хориокапиллярного слоя сосудистой оболочки; 6 — эндотелиальная клетка
В действительности можно считать, что мембрана Бруха состоит только из трех внутренних слоев, поскольку наружные слои относятся к другим образованиям.
Наиболее внутренний слой мембраны
, представленный базальной мембраной пигментного эпителия сетчатки, имеет толщину приблизительно 0,3 мкм. Внутренняя коллагеновая зона (толщиной 1,5 мкм) состоит из плотно упакованных и строго ориентированных фибрилл коллагена (диаметр волокон — 60 нм, а периодичность исчерченности — 64 нм). Коллаген относится, в основном, к коллагену IV типа. Волокна погружены в основное вещество, состоящее преимущественно из протеогликанов.
Средняя зона
(эластический слой) имеет толщину7 порядка 0,8 мкм, и в ней эластические волокна располагаются беспорядочно. Именно в этой зоне при старении и различных патологических состояниях отмечается накопление солей кальция и липидов.
Наружная коллагеновая зона
схожа по структуре с внутренней зоной. Единственным отличием является то, что она толще (0,7 мкм).
Наиболее наружный слой мембраны Бруха
, представленный базальной мембраной эндотелиальных клеток капилляров сосудистой оболочки. самый тонкий (0,14 мкм).
Нередко в области мембраны Бруха и клеток пигментного эпителия при офтальмоскопии можно обнаружить друзы
, развивающиеся в результате процессов старения или различных заболеваний (рис. 3.6.9).
Рис. 3.6.9.
Формирование друзы во внутреннем коллагеновом слое мембраны Бруха:
1 — клетки пигментного эпителия; 2— часть друзы, расположенной во внутреннем коллагеновом слое; 3 — наружная часть друзы, распространяющаяся на большом протяжении (стрелки)
Различают твердые и мягкие друзы
. Они могут то появляться, то регрессировать. Твердые друзы чаще встречаются у молодых людей и являются продуктом синтетической деятельности клеток пигментного эпителия. Мягкие друзы, содержащие в своем составе мембранные структуры, отражают общие нарушения функции клеток.
Мембрана Бруха выполняет разнообразные и важные функции, в первую очередь по избирательному транспорту питательных веществ и воды в направлении сетчатки. Именно мембрана Бруха вместе с хориокапиллярным слоем сосудистой оболочки и клетками пигментного эпителия образует своеобразную структурно-функциональную единицу
, обеспечивающую барьерные функции. Нарушение строения мембраны является причиной различных дегенеративных заболеваний пигментного эпителия (отслойка эпителия) и сенсорной части сетчатки (тапеторетинальная дегенерация, дегенерация макулярной области и др.). Способствуют этому ее возрастные изменения и формирование друз.
Продолжая описание клеток пигментного эпителия, необходимо указать на то, что они, как и другие эпителиальные клетки, в базальной своей части образуют многочисленные складки. На апикальной поверхности клеток определяется множество микроворсинок, простирающихся в пространстве между наружными сегментами фоторецепторов и окутывающих их. Выделяют два типа микроворсинок
. Первый тип имеет длину 5—7 мкм, а второй — 3 мкм. Микроворсинки значительно увеличивают площадь контакта клеток пигментного эпителия с фоторецепторами, способствуя тем самым высокому уровню метаболизма, благодаря увеличению интенсивности поставки питательных веществ сетчатке из хориокапиллярного слоя сосудистой оболочки и выведения из сетчатки воды, ионов и конечных продуктов метаболизма.
Между цитоплазматической мембраной микроворсинок эпителиоцитов и мембраной фоторецепторов никаких специализированных соединений нет и обнаруживается щелевидное пространство
(рис. 3.6.10).
Рис. 3.6.10.
Электроннограмма, иллюстрирующая характер взаимоотношения пигментного эпителия сетчатки с наружными сегментами палочек (по Hogan et al., 1971):
1 — ядро клетки пигментного эпителия; 2 — митохондрии; 3 — гладкая эндоплазматическая сеть; 4 — гранулы меланина; 5 — микроворсинки, расположенные на апикальной поверхности клеток пигментного эпителия и окружающие наружные членики палочек; 6 — наружный сегмент фоторецептора
Выполнено это пространство «цементирующей субстанцией» сложного химического состава. Называют его «интерфоторецепторный матрикс». Синтезируется он клетками пигментного эпителия. Интерфоторецепторный матрикс состоит из хондроитинсульфата (60%), сиаловой кислоты (25%) и гиалуроновой кислоты (15%). В настоящее время уточнен состав и функции этого вещества.
Первоначально предполагали, что матрикс
представляет собой гомогенное скопление протеогликанов. В настоящее время выявлено довольно сложное пространственное взаимодействие протеогликанов матрикса с наружными сегментами колбочек. Именно это взаимодействие и обеспечивает достаточно плотный контакт между пигментным эпителием и сетчаткой. Интерфоторецепторный матрикс участвует в метаболизме сетчатки, а именно в переносе ретиноида. Содействует он также фагоцитозу наружных сегментов фоторецепторов.
Нарушение структурной организации матрикса является немаловажной причиной возникновения отслойки сетчатки, а также сопровождает различные виды ее дегенерации.
Клетки пигментного эпителия плотно соединены между собой при помощи зон замыкания, опоясывающей десмосомы и щелевых контактов. Органоиды опоясывают клетки с апикальной стороны, плотно скрепляя их. В средней части клеток располагаются десмосомы. Подобный контакт делает невозможным прохождение метаболитов, особенно высокомолекулярных веществ, вдоль межклеточного пространства. Этот перенос происходит только через цитоплазму клетки активным путем. Именно подобный плотный межклеточный контакт обеспечивает возможность функционирования гемато-ретинального барьера.
В разных участках пигментного эпителиоцита цитоплазма имеет отличающееся ультраструктурное строение
. Именно по этой причине цитоплазму клетки условно подразделяют на 3 зоны. Во всех зонах определяется хорошо развитый агранулярный эндоплазматический ретикулум.
Внешняя треть цитоплазмы эпителиоцитов отличается наличием большого количества митохондрий и складок базальной мембраны
. Внутренняя треть цитоплазмы эпителиоцитов насыщена гранулами меланина. Видны также многочисленные свободные и связанные рибосомы. Промежуточная зона цитоплазмы относительно бедна органоидами (рис. 3.6.10). Именно здесь располагается ядро. Комплекс Гольджи выражен нечетко. Его цистерны содержат светлый материал, что свидетельствует о высокой секреторной активности клеток.
Во всех частях цитоплазмы эпителиоцитов располагаются лизосомы обычного строения
. Основной их функцией является ферментативное расщепление фагоцитированных фрагментов наружных члеников фоторецепторов.
Поскольку фагоцитарная активность клеток пигментного эпителия является одной из основных функций, их цитоплазма содержит фаголизосомы, образующиеся в результате слияния поглощенных наружных члеников фоторецепторов с первичной лизосомой.
В фаголизосоме первым подвергается лизису белковый компонент фоторецепторных дисков.
Процесс фагоцитоза и лизиса
сегментов наружных члеников фотороцепторов происходит довольно быстро. Одна клетка пигментного эпителия кролика в сутки подвергает лизису 2000 дисков в парафовеолярной области сетчатки, 3500 дисков в перифовеолярной области и почти 4000 по периферии сетчатки (рис. 3.6.11, 3.6.12).
Рис. 3.6.11.
Электроннограмма, иллюстрирующая стадии переваривания фрагментов наружных члеников фоторецепторов клетками пигментного эпителия:
1 — наружный членик колбочки; 2 — отделившийся фрагмент наружного членика колбочки и погруженный в цитоплазму клетки пигментного эпителия; 3 — фагосома. содержащая фрагмент наружного членика колбочки: 4 — фагосома на более поздней стадии переваривания фрагмента наружного членика: 5 — меланосомы; 6 — митохондрии
Рис. 3.6.12.
Последовательные стации (I—VI) поглощения и лизиса наружных члеников фоторецепторов пигментными эпителиоцитами сетчатой оболочки. При этом отмечается регенерация наружного членика фоторецептора:
1 — наружный членик фоторецептора; 2 — клетка пигментного эпителия; 3 — фагосома
Отмечено, что при интенсивном освещении количество фагосом увеличивается. Клетки пигментного эпителия отщепляют наружные членики колбочек таким же образом, как и палочек, но более интенсивно после прекращения освещения. Процесс разрушения наружных члеников колбочек и палочек фоторецепторов и их утилизации является адаптивным механизмом, способствующим поддержанию структурной и функциональной целостности фоторецепторного аппарата. Тем не менее гибель фоторецепторов возникает также при различных патологических состояниях. Нередко гибель клеток происходит благодаря механизмам апоптоза, находящимся под генетическим контролем.
В последнее время проводятся интенсивные исследования роли механизмов апоптоза в развитии большой группы наследуемых дегенеративных заболеваний сетчатой оболочки. Это направление исследований имеет большое практическое значение, поскольку известно более 100 генетически наследуемых синдромов, сопровождающихся гибелью нейронов сетчатой оболочки. Показано, что при некоторых наследуемых синдромах механизмы апоптоза играют ведущую роль. При этом апоптоз рассматривается как конечный механизм гибели клеток
, независимо от характера первичного повреждения. Основные типы повреждения фоторецепторов довольно разнообразны и сводятся к нарушению их важных функций (синтез зрительного пигмента, структуры цитоскелета клеток, последовательности процессов при восприятии световой энергии и ее трансформации в нервный импульс, фагоцитарные функции клеток пигментного эпителия и др.). Раскрытие механизмов апоптотической гибели нейронов сетчатки и участия в этом генетического аппарата рассматривается как наиболее перспективное направление в лечении этих заболеваний.
Нередким структурным включением цитоплазмы клетки пигментного эпителия сетчатки является липофусцин.
Липофусцин содержится во многих тканях организма и его количество нарастает с возрастом. Именно по этой причине этот пигмент был назван «пигментом старения»
. Возникает он в результате накопления в лизосомах стареющих клеток нелизирующихся агрегатов белка и липидов. Этот пигмент отличается характерными физико-химическими свойствами, включая естественную желтовато-зеленую флюоресценцию. Накопление липофусцина происходит не только в процессе старения, но и при ряде метаболических заболеваний. Причины и механизмы возникновения липофусциноза оставались загадкой более 100 лет. В настоящее время известно, что липофусцин возникает в результате перекисного окисления клеточных компонентов, особенно липидов.
В глазном яблоке, как было указано выше, липофусцин обнаруживается в пигментном эпителии сетчатки
. Максимальное его накопление происходит в клетках, расположенных в заднем полюсе. К 80 годам липофусциновые гранулы занимают до 19% объема эпителиоцитов. В отличие от других клеток организма, в которых возникает липофусцин в результате аутофагоцитоза внутриклеточных органелл, липофусцин в клетках пигментного эпителия сетчатки возникает в результате фагоцитоза наружных сегментов фоторецепторов с последующим перекисным окислением липидной фракции этих фрагментов. В этом процессе участвует коротковолновой спектр световой энергии.
В последнее время указывается на большую роль в формировании липофусцина в эпителиальных клетках сетчатки витамина А и его производных. Об этом свидетельствуют многочисленные экспериментальные биохимические, физикохимические исследования.
Зерна липофусцина необходимо морфологически отличать от меланосом
. Это имеет практическое значение при диагностике пигментных новообразований. Меланиновые гранулы эпителиоцитов имеют круглую или овальную форму. При этом круглые гранулы располагаются в апикальной части клетки, а овальные — в микроворсинках. Липофусциновые гранулы круглые, но менее электронноплотные. Окрашиваются они судановыми красителями и флюоресцирует. Число зерен липофусцина прогрессивно увеличивается с возрастом. Наоборот, количество меланосом с возрастом уменьшается. Полагают, что уменьшение количества меланосом связано с деятельностью лизосомного аппарата клеток и возрастным изменением меланина.
Меланин клеток пигментного эпителия поглощает световую энергию достаточно широкого спектра, защищая фоторецепторы и цитоплазму пигментных эпителиоцитов от повреждающего действия света. Меланин обладает свойством свободного радикала и функционирует так же, как полимер, участвующий в обмене электронов. Меланин связывает ряд металлов и лекарственных веществ.
Важно также помнить, что меланиновые гранулы пигментного эпителия сетчатки отличаются от меланосом стромальных меланоцитов увеального тракта
. Гранулы увеального меланина значительно меньшего размера и имеют овальную форму. Это важно знать патоморфологам, особенно при дифференциальной диагностике внутриглазных пигментных новообразований.
В апикальной части, а также вблизи комплекса Гольджи клеток пигментного эпителия выявляется большое количество пиносом
. Размер их меньше (53 нм), чем в эндотелиальных и других клетках (более 100 нм). Эти структуры указывают на наличие интенсивных процессов эндоцитоза, характерного для клеток пигментного эпителия.
В цитоплазме эпителиальных клеток можно также обнаружить дискретные темные частицы и пластинчатые тельца
. Последние представляют собой фрагменты поглощенных наружных сегментов фоторецепторов.
Продолжение в следующей статье: Сетчатка ? Часть 2
—-
Статья из книги: Строение зрительной системы человека | Вит В. В.
Клиническое значение
У альбиносов имеет место нарушение синтеза меланина, и в пигментном слое его почти нет. При нахождении альбиносов в ярко освещенной комнате, свет, попавший внутрь глазного яблока, отражается во всех направлениях непигментированной поверхностью сетчатки и ниже лежащими тканями. Это приводит к возбуждению одним отдельным лучом света большого количества палочек и колбочек, хотя у здорового человека возбуждается только несколько фоторецетпторов. Острота зрения у альбиносов даже при самой лучшей оптической коррекции редко превышает 0,2-0,1 (норма 1,0)[4].
В течение жизни в пигментном эпителии проходит накопление конечных продуктов, что не полностью распались — липофусцина; также проходит откладывание его между пигментным эпителием и мембраной Бруха в виде друз. Друзы является признаком развития возрастной макулодистрофии.
Нарушения со стороны пигментного эпителия сетчатки имеют место и при пигментном ретините.
При нарушении гемато-ретинального барьера (например, при сахарном диабете) развивается диабетическая ретинопатия.
Диагностика заболевания
Довольно тяжело диагностировать данное заболевание у маленьких детей и на ранних стадиях развития. У детей поставить диагноз можно только после того, как ребенок достигнет возраста 6-ти лет. Чаще всего заболевание обнаруживается, когда ребенок начинает испытывать определенные трудности ночью либо в сумерки.
Для подтверждения или опровержения диагноза «Дистрофия сетчатки» необходимо прохождение тщательного обследования зрительной системы. Диагностика выполняется при помощи современной компьютерной техники, позволяющей составить полноценную картину о зрении больного.
При подозрении на дистрофию сетчатки обследование пациента должно включать в себя ряд мероприятий.
- Определение остроты зрения.
- Периметрия (исследование полей зрения) для оценки состояния сетчатки на ее периферии — можно определить, какая область сетчатки поражена.
- Тонометрия (измерение давления внутри глаза).
- Офтальмоскопия (исследование глазного дна).
- Электрофизиологическое исследование — определяется жизнеспособность нейронов сетчатки и зрительного нерва.
- Флюоресцентная ангиография — позволяет визуализировать сосуды и оценить их состояние.
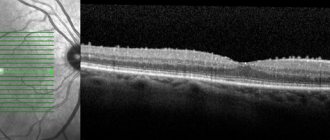
- ОКТ (оптическая когерентная томография) — неинвазивный метод исследования тонких слоёв глазных тканей человека, при котором делается послойное исследование структур глаза.
- УЗИ (ультразвуковое А- и В-сканирование) внутренних структур глаза.
Примечания
- ↑ 12
Foundational Model of Anatomy - ↑ 12Cassin, B. and Solomon, S.
Dictionary of eye terminology (неопр.). — Gainesville, Fla: Triad Pub. Co, 2001. — ISBN 0-937404-63-2. - Boyer MM, Poulsen GL, Nork TM. «Relative contributions of the neurosensory retina and retinal pigment epithelium to macular hypofluorescence.» Arch Ophthalmol. 2000 Jan;118(1):27-31. PMID 10636410.
- Гайтон А. К., Холл Д. Э.
Медицинская физиология = Textbook of Medical Physiology / под ред. В.И. Кобрина. — М.: Логосфера, 2008. — С. 699. — 1296 с. — ISBN 978-5-98657-013-6.